联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近日,卡罗林斯卡研究所的研究人员发表在《Nature Communications》上的一篇题为“Gsta4 controls apoptosis of differentiating adult oligodendrocytes during homeostasis and remyelination via the mitochondria-associated Fas-Casp8-Bid-axis”的文章,发现了谷胱甘肽S-转移酶4α (Gsta4,一种基因)是***神经系统的少突胶质细胞(OL)分化、存活和再髓鞘化的内在调节因子,也是可以治疗多发性硬化的潜在靶点。

Doi: 10.1038/s41467-020-17871-5
多发性硬化(MS),因多发于女性,所以也被称作“美女病”。MS是一种***神经系统慢性炎症相关的疾病,人体的免疫系统错误地攻击大脑和脊髓神经时,就会像杜普蕾一样,出现疲劳、平衡失调和肌肉无力等等症状。
当自身免疫系统的细胞迁移到大脑后,会破坏少突胶质细胞(OL)包裹在神经纤维外层起绝缘作用的髓鞘结构,导致“短路”,从而致使神经信号的正常传输受到阻碍,发展为多发性硬化(MS)。
少突前体细胞(OPC)是少突胶质细胞(OL)未成熟前的一种状态,OPC的增殖有助于OL的分化成熟。富马酸二甲酯(DMF)是一种广泛用于治疗多发性硬化症的药物,可促进OL成熟;富马酸氯马斯汀(Clem-F)可影响髓鞘的形成。
鉴于此,研究小组将这两种影响髓鞘成熟的药物作用于新生大鼠的OPC而进行相关的研究,发现Gsta4高度表达,DMF和Clem-F均通过诱导Gsta4来促进少OL的分化,他们还推测Gsta4为Nrf2(细胞应激的主要传感器)的靶标。
这意味着,高表达Gsta4的比具有正常基因水平的OL成熟地更快,并且活力更大,以更快地修复神经纤维外层的绝缘作用,DMF和Clem-F通过作用于Nrf2影响Gsta4的表达。
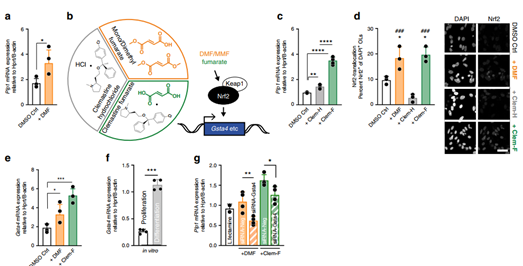
DMF和Clem-F上调Gsta4并促进OL分化
那么,谷胱甘肽S-转移酶4α(Gsta4)是如何影响髓鞘的成熟和分化呢?研究人员进一步评估了Gsta4对成年大鼠少突胶质细胞(OL)谱系的影响。结果发现Gsta4通过调节线粒体相关的Fas-Casp8-Bid轴来促进未成熟的OLs的增殖,从而提高成熟OLs的比例。更重要的是,Gsta4还可以促进OL的重新绝缘的作用(再髓鞘化),改善了大鼠的多发性硬化。
由于4-HNE是Gsta4酶活性的***已知底物,而线粒体应激导致的功能障碍与高负荷的4-HNE有密切相关。因此,研究人员考察了Gsta4、线粒体和多发性硬化之间的联系。结果发现,Gsta4过表达有助于降低线粒体压力和激活半胱氨酸蛋白酶-8(Casp8),进而导致较少的脱髓鞘现象和/或再髓鞘化,有效改善了实验动物多发性硬化的临床症状。