联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
今日,***新一期《科学》杂志如约上线。我们很高兴地看到,颜宁教授团队同日在线发表了两篇论文。随着这两篇论文的上线,我们对于电压门控钠离子通道(voltage-gated Nav)的理解,又加深了一层。

Nav通道是潜在的重要制药靶点。其中,Nav1.7的突变与许多疼痛综合征相关,因此它也成为了许多医药公司研发新型止痛剂的靶标。如果能获得Nav1.7的精准结构模型,无疑会为新药研发人员发现新药带来更多便捷。
先前的一些研究表明,Nav通道能与许多天然毒素结合。这些分子一般可以被分为两类,一类是孔隙阻滞剂(pore blocker),它们通过堵塞离子通道孔隙来抑制钠离子的流动,这类神经毒素包括河豚毒素(tetrodotoxin,TTX)和石房蛤毒素(saxitoxin,STX)。第二类神经毒素称为门控调节毒素(gatingmodifier toxins,GMTs),它们通过复杂的别构效应将离子通道的构像固定在一个状态,从而达到抑制或激活离子通道的效果。
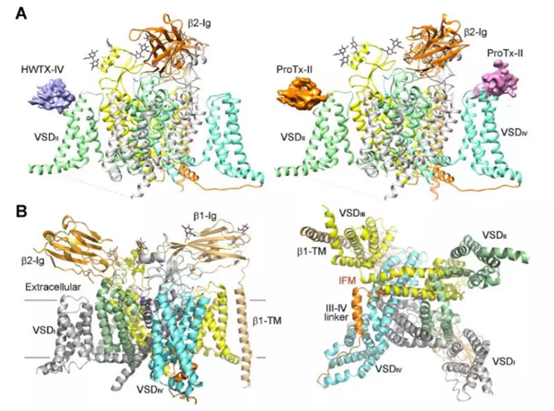
▲本研究获得的两个结构
在***篇论文里,研究人员们使用了两种“孔隙阻滞剂+门控调节毒素”的组合:河豚毒素+原毒素II(Protoxin-II),以及石房蛤毒素+Huwentoxin-IV。随后,他们使用单粒子冷冻电镜技术,解析了带有β1和β2辅助亚基的Nav1.7通道,分别与这两个毒素组合相结合时,形成的复合体结构。据报道,这两个结构都达到了3.2Å的总分辨率。
对比来看,无论是与河豚毒素+原毒素II结合,还是与石房蛤毒素+ Huwentoxin-IV结合,复合体的总体结构都差不多。***的构象区别出现在Nav通道的电压感应域II(VSD II)上,这是由于与之结合的门控调节毒素有所不同。此外,研究人员们也发现,在电压感应域II(VSD IV)上,还能结合一个额外的原毒素II。
这些结构为我们理解Nav1.7的结构与工作机理提供了新的工具。正如研究人员们在摘要中所言,它“为开发止痛药奠定了结构基础”。

在第二篇论文里,研究团队把目光聚焦在了Nav1.2上。在***神经系统里,Nav1.2对于动作电位的产生和传播有着非常重要的意义。
与Nav1.7一样,Nav1.2同样可以被孔隙阻滞剂和门控调节毒素所抑制。其中,孔隙阻滞剂按其分子性质,又可以分为小分子阻滞剂和肽类阻滞剂。后者对于Nav亚型往往有着更高的特异性,有着更好的成药潜力,因此也是许多医药研发人员所关注的***。然而在结构上,我们依旧不清楚Nav通道与肽类阻滞剂的识别机制。
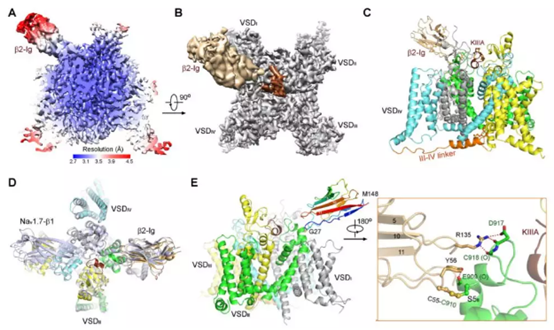
▲本研究获得的结构示意图
这正是本研究所解决的难题。研究团队使用冷冻电镜技术,获得了带有β2辅助亚基的人类Nav1.2与肽类阻滞剂芋螺毒素(μ-conotoxin KIIIA,下称KIIIA)相结合下的结构,总分辨率达到3.0Å。
该结构指出,由16个氨基酸组成的KIIIA虽然不大,但能够与Nav1.2的胞外部分形成广泛的极性结合。总体来看,该肽类阻滞剂的结构也与Nav1.2的胞外部分有高度互补。研究人员们指出,两者的结合所需要的氨基酸残基,对Nav1.2有着极高的特异性,这也从分子机理上解释了KIIIA为何能特异性抑制Nav1.2。