联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
10月17日,Plant Physiology杂志在线发表了山东农业大学长江学者郝玉金团队题为“The SUMO E3 ligase MdSIZ1 targets MdbHLH104 to regulate plasma membrane H+-ATPase activity and iron homeostasis”的研究论文,在苹果铁素营养平衡调控机理研究中取得新进展。
铁是植物生长发育过程中的必需矿质元素,铁缺乏或过量都会对植物造成伤害。虽然铁元素在地壳中的含量很高,但是在含氧量丰富的土壤及盐碱地中,铁离子很容易转变为难以被植物吸收利用的氢氧化物,造成缺铁胁迫;相反,在亚洲及非洲的湿润性土壤中,铁毒害则是作物主要的生理性病害。植物吸收的过量Fe2+会诱发活性氧物质的积累,对植物细胞造成损伤。因此,植物必须对铁离子的吸收进行精细地调控。
郝玉金教授团队长期致力于苹果优良抗性砧木的遗传改良,该团队从苹果铁吸收的转录调控入手,发现一类bHLH转录因子MdbHLH104可以结合在苹果根系质膜质子泵基因MdAHA8的启动子上,在缺铁条件下转录激活其表达,促进苹果根际质子外泌,酸化土壤,增加铁离子的溶解度,进而提高苹果对土壤中铁离子的吸收效率(Zhao et al. Plant Biotechnol. J 2014, 14:1633-1645)。该团队的进一步研究表明,在富铁条件下,BTB-TAZ骨架蛋白MdBTs(MdBT1/MdBT2)被诱导并与MdCUL3互作,形成CRL3 E3连接酶复合体,促进MdbHLH104蛋白通过泛素/26S蛋白酶体途径降解,防止苹果在富铁条件下对铁离子的过量吸收(Zhao et al. Plant Physiol 2016, 172:1973-1988)。然而,在缺铁条件下,植物铁吸收过程中的转录因子,特别是MdbHLH104在翻译后水平的正调控机制却并不清楚。
在本研究中,作者发现一类SUMO E3连接酶MdSIZ1可以与MdbHLH104转录因子直接互作,于缺铁条件下在第139位和第153位赖氨酸处对MdbHLH104蛋白进行SUMO化修饰,提高MdbHLH104蛋白的稳定性,促进其对下游MdAHA8基因的转录激活,提高土壤中铁离子的溶解度和吸收利用效率。进一步研究发现,MdSIZ1同时以不依赖MdbHLH104的方式调控了质膜质子泵基因MdAHA1和MdAHA9的表达,并通过促进MdbHLH104对Ib亚家族bHLH转录因子MdbHLH38和MdbHLH39的转录调控,促进了铁离子在植物中的还原和吸收过程。这也是在植物中***次发现SUMO化作为一种蛋白质翻译后修饰方式,参与植物对铁素营养平衡的调控。
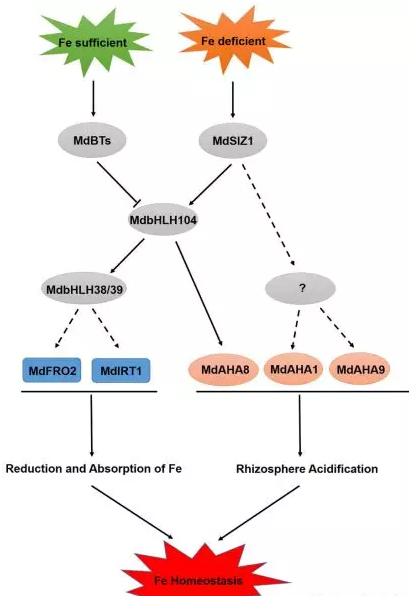
图1. MdSIZ1应答缺铁逆境,促进苹果铁吸收动态平衡的调控机制